Рубрики
- Бактериальные инфекции (41)
- Биохимия (5)
- Вирусные гепатиты (12)
- Вирусные инфекции (43)
- ВИЧ-СПИД (28)
- Диагностика (30)
- Зооантропонозные инфекции (19)
- Иммунитет (16)
- Инфекционные заболевания кожи (33)
- Лечение (38)
- Общие знания об инфекциях (36)
- Паразитарные заболевания (8)
- Правильное питание (41)
- Профилактика (23)
- Разное (3)
- Сепсис (7)
- Стандарты медицинской помощи (26)
 «Расщепление белков в желудочно-кишечном тракте» — это первая из четырёх статья из цикла «Обмен белков в организме человека»
«Расщепление белков в желудочно-кишечном тракте» — это первая из четырёх статья из цикла «Обмен белков в организме человека»
В течение всей жизни в организме происходят одновременно разрушения и биосинтез клеток и тканей. Эти противоположные, но тесно связанные между собой процессы — ассимиляция и диссимиляция — составляют основу жизни. Итак, в организм должны постоянно поступать вещества, необходимые для построения новых клеток. Главная роль в этом принадлежит белкам, так как ни углеводы, ни жиры не могут их заменить в образовании основных структурных элементов органов и тканей. Среди различных преобразований, присущих живой материи, основное место занимает белковый обмен .
В связи с тем, что белки являются азотсодержащими веществами, одним из методов, характеризующим состояние белкового обмена в организме, может быть определение баланса азота. У здорового человека при нормальном питании отмечается состояние белкового равновесия, когда поступление азота компенсирует его затраты. При отрицательном азотистом балансе количество выведенного азота превышает его количество, поступающее в составе белков. Такое состояние может наблюдаться при нарушении деятельности пищеварительной системы, белковом голодании и т п.
Положительный азотистый баланс бывает в тех случаях, когда количество выведенного азота меньше того, что поступает в составе белков. Это характерно для растущего организма, при беременности, при повышении активности процессов биосинтеза белка (например, при физических нагрузках).
Для синтеза белков в организме необходимы различные аминокислоты. Некоторые из них, образующиеся в самом организме, называются заменимыми . Аминокислоты, не синтезирующиеся в организме человека, называются незаменимыми . Они должны регулярно поступать с пищей. Белки, в состав которых входят заменимые и незаменимые аминокислоты в соотношениях, приближающихся к таковым в организме, называют полноценными .
Среди пищевых продуктов практически нет белков, которые полностью соответствуют этим требованиям. Наиболее близки к полноценному белки материнского молока, куриного яйца. Итак, для полного обеспечения здорового организма полноценными белками в суточный рацион должны быть включены различные пищевые продукты как животного, так и растительного происхождения.
Для нормальной жизнедеятельности человека необходимо поступление такого количества полноценного белка, которое будет покрывать все потребности организма. Оно зависит от пола, возраста, интенсивности труда и т.д. С учетом этих факторов разработаны нормы белкового питания. Недостаточное потребление белков приводит к нарушению процессов жизнедеятельности, ухудшению здоровья, а длительное белковое голодание неизбежно заканчивается гибелью.
Белки необходимы для организма, прежде всего, как пластический материал, из которого строятся клетки всех тканей, органов и систем. Однако пищевые белки не могут быть использованы без предварительного расщепления в организме, так как они имеют сложную структуру и видовую специфичность.
Расщепление (гидролиз) белков на аминокислоты, которые лишены видовой и тканевой специфичности, происходит в желудочно-кишечном тракте.
Расщепление белков в пищеварительном тракте (ЖКТ).
Переваривание питательных веществ (белков, углеводов, липидов) — это процесс гидролиза соответствующих соединений, входящих в состав продуктов питания, который происходит в пищеварительном тракте и приводит к образованию простых биомолекул. Последние за счет действия специфических механизмов мембранного транспорта всасываются в кровь или лимфу.
Переваривание белков начинается в желудке под действием желудочного сока. В состав желудочного сока входит соляная кислота, которая вырабатывается обкладочными клетками слизистой оболочки желудка. Она денатурирует белок, облегчает его последующее расщепление. В состав желудочного сока входят кислые фосфаты и некоторые органические кислоты. Соляная кислота способствует превращению профермента пепсиногена, который секретируется главными клетками слизистой оболочки желудка, в активный протеолитический фермент пепсин .
Оптимальная концентрация водородных ионов для пепсина составляет 1,5 — 2,5, что соответствует кислотности желудочного сока в процессе пищеварения. При увеличении рН среды до 6,0 (в кишечнике) пепсин теряет свою активность. Пепсин относится к однокомпонентным ферментам, то есть к ферментам-протеинам. За сутки в желудке вырабатывается около 2 г пепсина.
Каталитическая активность пепсина желудка очень высока. Он катализирует расщепление пептидных связей в молекуле белка, образованных аминогруппами ароматических и дикарбоновых аминокислот. В результате действия пепсина образуются полипептиды различной величины и отдельные свободные аминокислоты.
Кроме пепсина, в желудочном соке содержится протеолитический фермент гастриксин , оптимальное значение рН которого находятся в пределах 3,5 — 4,5. Гастриксин вступает в действие на последних этапах переваривания пищи в желудке.
В желудке грудных детей обнаружен сычужный фермент — химозин. Оптимум действия этого фермента рН 3,5 — 4,0. Под влиянием химозина в присутствии солей кальция казеиноген молока в ходе гидролиза превращается в казеин и молоко свёртывается.
Легче других в желудке перевариваются альбумины и глобулины животного и растительного происхождения; плохо расщепляются белки соединительной ткани (коллаген и эластин) и совсем не расщепляются кератин и протамины.
Частично переваренная полужидкая масса питательных соединений, которая образуется в желудке (химус) периодически поступает через пилорический клапан в двенадцатиперстную кишку. В эту часть пищеварительного канала поступают из поджелудочной железы протеолитические ферменты и пептидазы, которые действуют на пептиды, поступающие из желудка. Каталитическое действие этих ферментов происходит в слабощелочной среде (рН 7,5 — 8,0), которая образуется имеющимися в кишечном соке бикарбонатами.
Большинство ферментов протеолитического действия, функционирующих в тонкой кишке, синтезируются в экзокринных клетках поджелудочной железы в виде проферментов, которые активируются после их поступления в двенадцатиперстную кишку (трипсиноген, химотрипсиноген, проэластаза, прокарбоксипептидазы А и Б). Гидролиз белков и пептидов, поступающих из желудка, происходит как в полости тонкой кишки, так и на поверхности энтероцитов — пристеночное или мембранное пищеварение .
Сок поджелудочной железы поступает в двенадцатиперстную кишку и смешивается с кишечным соком. Эта смесь содержит протеолитические ферменты, расщепляющие белки, альбумозы и пептоны до небольших пептидов, а затем до аминокислот. К протеолитическим ферментам относятся трипсин, химотрипсин, карбоксипептидазы, аминопептидазы и большая группа три- и дипептидаз.
Трипсин находится в соке поджелудочной железы в неактивной форме, в виде профермента трипсиногена . Его активация происходит под действием фермента кишечного сока — энтерокиназы. Для процесса активации необходимы ионы Са 2+. Процесс преобразования трипсиногена в трипсин осуществляется путем отщепления небольшого пептида с N-конца пептидной цепи фермента.
Трипсин гидролизует как нерасщепленные в желудке белки, так и высокомолекулярные пептиды, действуя главным образом на пептидные связи между аргинином и лизином. Оптимум рН для трипсина составляет 7,0 — 8,0. Трипсин делает сравнительно неглубокий гидролиз белка, образует полипептиды и небольшое количество свободных аминокислот.
Активность трипсина может снижаться под влиянием ряда ингибиторов. К ним относятся основные пептиды с молекулярной массой 9000 ед. Они обнаружены в поджелудочной железе, крови, легких, в бобах сои. Снижает активность трипсина и мукопротеин, содержащийся в сырых яйцах — авидин .
Химотрипсин — второй протеолитический фермент поджелудочной железы. Он также секретируется в неактивной форме, в виде химотрипсиногена. Под действием трипсина химотрипсиноген переходит в активный фермент — химотрипсин. Действие химотрипсина подобно действию трипсина. Оптимум рН для обоих ферментов примерно одинаковый, химотрипсин действует на белки и полипептиды, содержащие ароматические аминокислоты (тирозин, фенилаланин, триптофан), а также на пептидные связи, которые не подвергаются воздействию трипсина (метионин, лейцин).
Пептиды, которые образуютсяся в результате воздействия на белки пепсина, трипсина и химотрипсина в нижних отделах тонкой кишки, подвергаются дальнейшему расщеплению. Этот процесс осуществляют карбоксипептидазы, аминопептидазы . Эти ферменты относятся к металлоферментам. Они активируются двухвалентными ионами: Mg 2+ , Mn 2+ , Со 2+ , которые играют важную роль в формировании фермент-субстратного комплекса.
Механизм действия амино- и карбоксипептидаз заключается в отщеплении от пептидов конечных аминокислот, имеющих свободную аминную или карбоксильную группу. Небольшие пептиды, которые остались нерасщепленными и состоят из трех-четырех аминокислотных остатков, подвергаются гидролизу специфическими ди- и триаминопептидазами . В соке поджелудочной железы присутствует фермент эластаза . Эластаза — эндопептидаза, которая также имеет широкую субстратную специфичность, расщепляя пептидные связи, образующиеся остатками аминокислот малого размера — глицина, аланина, серина.
Таким образом, в результате последовательного действия на белки протеолитических ферментов в кишечнике образуются свободные аминокислоты, которые всасываются в кровь через стенку кишечника.
Следующая вторая статья из цикла «Обмен белков в организме человека» — « Обезвреживание продуктов гниения белков в кишечнике ». Третья статья « Обмен аминокислот в тканях »
Расщепление белков до аминокислот начинается в желудке, продолжается в двенадцатиперстной кишке и заканчивается в тонком кишечнике. В некоторых случаях распад белков и превращения аминокислот могут происходить также в толстом кишечнике под влиянием микрофлоры.
Протеолитические ферменты подразделяют по особенности их действия на экзопептидазы , отщепляющие концевые аминокислоты, и эндопептидазы , действующие на внутренние пептидные связи.
В желудке пища подвергается воздействию желудочного сока, включающего соляную кислоту и ферменты. К ферментам желудка относятся две группы протеаз с разным оптимумом рН, которые упрощенно называют пепсин и гастриксин . У грудных детей основным ферментом является реннин .
Регуляция желудочного пищеварения
Регуляция осуществляется нервными (условные и безусловные рефлексы) и гуморальными механизмами. К гуморальным регуляторам желудочной секреции относятся гастрин и гистамин.
Гастрин секретируется специфичными G-клетками:
- в ответ на раздражение механорецепторов,
- в ответ на раздражение хеморецепторов (продукты первичного гидролиза белков),
- под влиянием n.vagus.
Далее гастрин через системный кровоток достигает и стимулирует главные, обкладочные и добавочные клетки, что вызывает секрецию желудочного сока, в большей мере соляной кислоты. Также он влияет на ECL-клетки и обеспечивает секрецию гистамина.
Гистамин , образующийся в энтерохромаффиноподобных клетках слизистой оболочки желудка (ECL-клетки, фундальные железы), выходит в кровоток и взаимодействует с Н2-рецепторами на обкладочных клетках, увеличивает в них синтез и секрецию соляной кислоты.
Закисление желудочного содержимого (pH 1,0) по механизму обратной отрицательной связи подавляет активность G-клеток, снижает секрецию гастрина и желудочного сока.
Соляная кислота
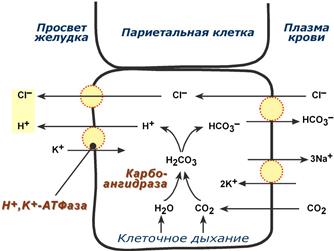
Одним из компонентов желудочного сока является соляная кислота. В образовании соляной кислоты принимают участие париетальные (обкладочные) клетки желудка, секретирующие ионы Н + . Источником ионов Н + является угольная кислота, образуемая ферментом карбоангидразой . При ее диссоциациии , кроме ионов водорода, образуются карбонат-ионы НСО3 – . Они по градиенту концентрации движутся в кровь в обмен на ионы Сl – . В полость желудка ионы Н + попадают энергозависимым антипортом с ионами К + (Н + ,К + -АТФаза), хлорид-ионы перекачиваются в просвет желудка также с затратой энергии.
При нарушении нормальной секреции HCl возникают гипоацидный или гиперацидный гастрит, отличающиеся друг от друга по клиническим проявлениям, последствиям и требуемой схеме лечения.
Синтез соляной кислоты
Функции соляной кислоты
- денатурация белков пищи,
- бактерицидное действие,
- высвобождение железа из комплекса с белками и перевод в двухвалентную форму, что необходимо для его всасывания. Аналогично высвобождаются и другие металлы,
- высвобождение различных органических молекул, прочно связанных с белковой частью (гем, коферменты — тиаминдифосфат, ФАД, ФМН, пиридоксальфосфат, кобаламин, биотин), что позволяет витаминам впоследствии всасываться,
- превращение неактивного пепсиногена в активный пепсин,
- снижение рН желудочного содержимого до 1,5-2,5 и создание оптимума рН для работы пепсина,
- после перехода в 12-перстную кишку – стимуляция секреции кишечных гормонов и, следовательно, выделения панкреатического сока и желчи.
Кислая реакция желудочного сока обусловлена, главным образом, присутствием HCl, гораздо в меньшей степени иона H2PO4 — , при патологиях (гипо- и анацидное состояние, онкология) свой вклад может вносить молочная кислота.
Совокупность всех веществ желудочного сока, способных быть донорами протонов, составляет общую кислотность. Соляную кислоту, находящуюся в комплексе с белками, мукополисахаридами слизистой оболочки и продуктами переваривания, называют связанной соляной кислотой, оставшуюся часть — свободной соляной кислотой. Содержание свободной HCl подвержено изменениям, в то же время количество связанной HCl относительно постоянно.
Влияние гастрина и гистамина на обкладочные клетки сводится к усилению работы Н + ,К + -АТФазы. Действие гастрина заключается в активации кальций-фосфолипидного механизма передачи сигнала, гистамин действует по аденилатциклазному механизму.
Изменение кислотности в желудке
Гипоацидное состояние развивается при снижении активности и/или количества обкладочных клеток, синтезирующих HCl. В результате могут развиваться самые разнообразные последствия, прямо или косвенно связанные с невыполнением соляной кислотой ее функций:
- снижение переваривания белков как в желудке, так и в кишечнике,
- активация процессов брожения в желудке, запах изо рта,
- активация процесса гниения белков в толстой кишке, бурление в кишечнике и метеоризм,
- проникновение недопереваренных продуктов в кровь и, как следствие, аллергические реакции,
- уменьшение высвобождения от белков и возникновение дефицита минеральных веществ (железо, медь, магний, цинк, йод и др),
- снижение высвобождения и всасывания ряда витаминов – развитие гиповитаминозов (B1, B2, B6, B12, H),
- снижение синтеза обкладочными клетками внутреннего фактора Касла и снижение всасывания витамина B12,
- снижение секреции кишечных гормонов и, как следствие, уменьшение выделения желчи и панкреатического сока,
- нарушение переваривания и всасывания липидов и, как следствие, развитие гиповитаминозов по жирорастворимым витаминам.
Гиперацидное состояние развивается при повышенной активности обкладочных клеток. Может приводить к клиническим проявлениям в виде воспаления стенки желудка, эрозии и язвенной болезни желудка и двенадцатипеперстной кишки.
Пепсин
Пепсин является эндопептидазой , то есть он расщепляет внутренние пептидные связи в молекулах белков и пептидов. Синтезируется в главных клетках желудка в виде неактивного профермента пепсиногена, в котором активный центр "прикрыт" N-концевым фрагментом. При наличии соляной кислоты конформация пепсиногена изменяется таким образом, что "раскрывается" активный центр фермента, который отщепляет остаточный пептид (N-концевой фрагмент), т.е. происходит аутокатализ . В результате образуется активный пепсин, активирующий и другие молекулы пепсиногена.
Превращение пепсиногена в пепсин
Пепсин обладает невысокой специфичностью, в основном он гидролизует пептидные связи, образованные аминогруппами ароматических аминокислот (тирозина, фенилаланина, триптофана), меньше и медленнее – аминогруппами и карбоксигруппами лейцина , глутаминовой кислоты и т.д. Оптимум рН для работы пепсина 1,5-2,0.
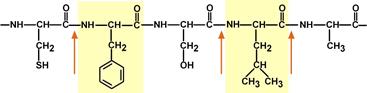
Связи, расщепляемые пепсином
Гастриксин
Гастриксин по своим функциям близок к пепсину, его количество в желудочном соке составляет 20-50% от количества пепсина. Синтезируется главными клетками желудка в виде профермента и активируется соляной кислотой. Оптимум рН гастриксина соответствует 3,2-3,5 и значение этот фермент имеет при питании молочно-растительной пищей, слабее стимулирующей выделение соляной кислоты и одновременно нейтрализующей ее в просвете желудка. Гастриксин является эндопептидазой и гидролизует связи, образованные карбоксильными группами дикарбоновых аминокислот.
Основное назначение желудка – это начальная стадия переваривания белков и в меньшей степени жиров. Главную роль в этом процессе играют ферменты желудка, а также соляная кислота. Эти вещества вырабатываются особыми клетками слизистой оболочки желудка, и все вместе носят название желудочного сока.

Пепсин
Фермент желудка, расщепляющий белки называется пепсин. Изначально пепсин, по структуре, как и все ферменты, белок, вырабатывается в своей неактивной форме, которую называют песиногеном. Молекула пепсиногена во всем похожа на молекулу пепсина, но с еще одной дополнительно присоединенной частью. Под действием соляной кислоты эта часть отделяется, и пепсиноген превращается в готовый к работе пепсин. В дальнейшем уже активированные молекулы пепсина самостоятельно активируют своих соседок – это называется аутокатализом. Существует несколько видов пепсина, которые воздействуют на разные виды белка. К основным видам относятся пепсин А, пепсин C (также известный как гастриксин) и пепсин B.
Все виды пепсина активны только в кислой среде, поэтому самая бурная их работа происходит в непосредственной близости к стенке в фундальной части желудка и в области его тела. Там pH самый низкий (достигает 1,5-2). Но это не значит, что качественно переварится только те белки, которые находятся на поверхности сформировавшегося пищевого комка: с помощью перистальтической волны (обеспечивается мощным мышечным слоем желудка), слой пищи, непосредственно контактировавший со слизистой, сдвигается ближе к нижней, пилорической части желудка, а нижележащий слой занимает его место. Так что все белки, которые вы употребили, будут эффективно переварены. Ферменты расщепляют белок до такого состояния, в котором продукты его переваривания становятся растворимы в воде. Затем содержимое желудка поступает в тонкий кишечник, где завершается переваривание и происходит всасывание питательных веществ вообще и белков в частности.
Липаза
Липазой называется фермент, расщепляющий липиды или попросту – жиры. Однако у взрослых людей липаза желудка не играет особой роли в переваривании жиров (чего нельзя сказать о младенцах). Для полноценного воздействия ее слишком мало, да и оптимальный pH ее действия несколько более щелочной, чем в желудке. Тем не менее, высокая температура и перистальтическая активность способствуют эмульгированию жира – разделению его на мельчайшие капельки, что увеличивает его поверхность, а, следовательно, и эффективность воздействия ферментов. Все это облегчает переваривание жиров в тонком кишечнике. Что интересно, в желудке до сих пор не найдены клетки, которые бы синтезировали липазу, ученые склоняются к мнению, что она каким-то образом секретируется из крови.
Соляная кислота
Соляная кислота, строго говоря, не является ферментом, ведь все ферменты желудка человека, да и вообще все ферменты – белки, а соляная кислота вообще относится к неорганическим веществам, и все же не упомянуть ее невозможно, слишком обширна ее роль в пищеварении. Во-первых, она вызывает денатурацию белка, то есть его разрушение подобное тому, какое происходит при термической обработке пищи. Без этого полное переваривание было бы невозможно. Во-вторых, как уже говорилась, она активирует ферменты. В-третьих, обладает мощным бактерицидным эффектом, что не позволяет бактериям выжить, а тем более размножаться в полости желудка и вызывать тем самым гниение пищи.
Процесс пищеварения – это совокупность химических и механических реакций, направленную на расщепление пищи, всасывание и усвоение ее клетками организма. Особую роль в переваривании пищи играют ферменты желудка, которые вырабатывает его слизистая оболочка. Ферменты во много раз ускоряют всасывание.
В желудке происходят два основных пищеварительных процесса:
- Перемешивание пищи до состояния химуса – однородная полужидкая масса;
- Ферментативный процесс: расщепление белков и жиров до более простых соединений.

Стенки желудка выстилает слизистая оболочка толщиной около 2 мм. В ней расположены секреторные железы, которые реагируют процесс выделения слюны в ротовой полости выбросом биологически активных веществ. Ферменты вырабатываются с интервалом 20 секунд. Их активность зависит от различных факторов: количество поступившей в организм пищи, ее жирность, кислотность и многое другое. Наиболее подходящей для деятельности ферментов считается температура 38–42 °C.
В желудке происходит всасывание воды, алкоголя, глюкозы и аминокислот. Ферменты желудочного сока обеспечивают гидролиз протеинов и липидов, то есть процесс расщепления белков на альбумозы и пептины и некоторых жиров до глицеринов и кислот. Затем эти вещества в составе химуса из-за сокращения гладких мышц желудка продвигаются в тонкий кишечник.

Весь желудочно-кишечный тракт имеет железы, выделяющие ферменты для переваривания пищи. Основная их задача – интенсивная переработка химуса. Недостаток необходимых биологически активных веществ может приводить к нарушению всасываемости, гнилостным процессам и диспепсическим явлениям: диарее, запору, избыточному газообразованию и т. д. В состав желудочного сока входят основные пять ферментов, отвечающие за нормальное пищеварение.
Тело и дно желудка содержат железы, выделяющие пепсиноген. Это профермент – неактивный предшественник пепсина, он начинает функционировать только при попадании в соляную кислоту. Именно поэтому пепсин действует только в желудке, при занесении вместе с пищей в кишечник он теряет свои свойства.
Пепсины – это протеиназы, то есть ферменты, которые расщепляют сложные белки до более простых. Они воздействует на большинство протеинов растительного и животного происхождения. Под действием соляной кислоты от пепсиногена отсоединяются 44 аминокислоты. В результате этой химической реакции образуется пепсин, готовый к работе. В дальнейшем фермент действует по принципу аутокатализа, то есть самостоятельно активирует другие молекулы пепсина.

Так как пепсин активен только в кислой среде, то основные вызванные им процессы происходят в области дна желудка. Именно здесь выделяется соляная кислота. Чтобы воздействию биологически активных веществ подверглись все белки, перистальтические волны желудка обеспечивают постоянное движение пищевых масс. В течение нескольких часов химус подвергается обработке, после чего белки становятся гидролитичными, то есть приобретают способность растворяться в воде. Дальнейший пищеварительный процесс осуществляется в тонком кишечнике.
Гастриксин также является протеолитическим веществом, стимулирующим расщепление белка. По своим функциям он очень схож с пепсином, поэтому зачастую в различных классификациях он фигурирует как пепсин II или пепсин С. Кроме того, гастриксин стимулирует выработку соляной кислоты. Именно поэтому в процессе пищеварения количество выделяемого желудочного сока постепенно увеличивается.
Пепсин активен при 1,5–2 pH, гастриксину для функционирования необходим меньший уровень кислотности – 3–3,5 pH. Действует он в основном в пристеночных отделах тела желудка. Гастроксин – второй по содержанию желудочный фермент, в норме он составляет 23–26% от объема пепсина. В совокупности эти биологически активные вещества обеспечивают около 98% расщепления белков в желудке.
Париетальные клетки желудка, то есть ответственные за производство соляной кислоты, вырабатывают также фермент парапепсин. Он, как и гастриксин или пепсин, обеспечивает распад протеиновых соединений. Особенность парапепсина в том, что он воздействует исключительно на белки соединительной ткани. Необходимым условием для действия этого фермента является низкая кислотность – не более 5,5 pH.
Химозин – фермент для расщепления белка, который вырабатывается клетками слизистой желудка. Также его называют сычужным ферментом, эту разновидность химозина получают путем вытяжки секрета желудка жвачных животных и используют для створаживания молока. Оптимальный уровень кислотности для функционирования биологически активного вещества – pH менее 5.

В процессе пищеварения химозин необходим для расщепления протеинов молока. Недостаток этого фермента приводит к непереносимости белка казеина и сильным расстройствам работы желудочно-кишечного тракта при употреблении молочных продуктов. Наибольшее количество ренина производится в организме детей до 11–13 лет.
В промышленности синтетический химозин используется для изготовления сыров и творожных изделий. На сегодняшний день существуют способы получения фермента как животного, так и растительного происхождения.
Также в желудочном соке содержится небольшое количество антибактериального вещества лизоцима. Зачастую путем обратной перистальтики при переваривании жирной пищи в желудок забрасывается кишечный фермент липаза. Кроме того, и соляная кислота способна частично расщеплять некоторые липиды, однако принцип воздействия в данном случае до сих пор не установлен.
Недостаток ферментов в желудочном соке приводит к нарушению пищеварения, развитию процессов брожения и гниения. Если белок не начинает перевариваться в желудке, то в дальнейшем в кишечнике он не может расщепиться до аминокислот. Такой патологический процесс вызывает избыток свободных протеинов. Помимо патологий работы пищеварительного тракта появляется еще одна проблема: белки связываются с содержащимися в кишечнике чужеродными организму веществами — антигенами. В результате образуется так называемый полноценный антиген. Он вступает в реакцию с лимфоцитами и провоцирует выработку антител иммунной системой человека. Эти нарушения приводят к развитию различных кожных заболеваний: экземы, дерматита, крапивницы, нейродермита.

Длительный дефицит ферментов желудка вызывает сбои в работе всего желудочно-кишечного тракта, печени и поджелудочной железы. Если биологически активных веществ недостаточно не только в желудке, но и в кишечнике, то развивается синдром мальдигестии. Это расстройство пищеварения, при котором не усваиваются любые поступающие в организм питательные вещества. Такое состояние требует срочного лечения.
Симптомы дефицита ферментов
Недостаток ферментов желудка может проявляться следующими признаками:
- Метеоризм. Развивается в результате процессов брожения, из-за которых в желудочно-кишечном тракте скапливаются газы;
- Обильное срыгивание воздуха после принятия пищи. В тяжелых случаях отрыжка может вызывать приступы рвоты;
- Изменение цвета, консистенции и объема каловых масс. Часто секреторная недостаточность желудка сопровождается нарушениями стула: фекалии могут приобрести гнилостный запах, творожистую или пенистую консистенцию;
- Изжога – ощущение жжения и боль в верхней части живота;
- Ухудшение состояния волос, кожи и ногтей;
- Снижение аппетита, которое может быть вызвано вздутием живота и болью в желудке.
Причины недостатка ферментов
На количество вырабатываемых желудком ферментов негативно влияет длительный прием антибактериальных препаратов, грибковые или инфекционные заболевания. К факторам риска относят также злоупотребление жирной и острой пищей, копченостями, алкоголем.
Дефицит ферментов желудка может свидетельствовать о более серьезных заболеваниях, например, язвенной болезни или опухолевых процессах. В таком случае к расстройству пищеварения присоединяется сильная боль в животе, тошнота или рвота, ощущение общего недомогания.
Ферменты в желудке необходимы для нормального переваривания и усвоения пищи. В случае появления дискомфорта после еды или диспепсических явлений рекомендуется обратиться в больницу и сдать анализ кала для определения секреторной активности желудка.

