Рак толстой кишки включает рак ободочной и прямой кишки.
Для его определения часто используют термин «колоректальный рак» (КРР).
По данным МАИР (Международное агентство по изучению рака), КРР в структуре онкологической заболеваемости у мужчин находится на 4-м месте, у женщин — на 3-м.
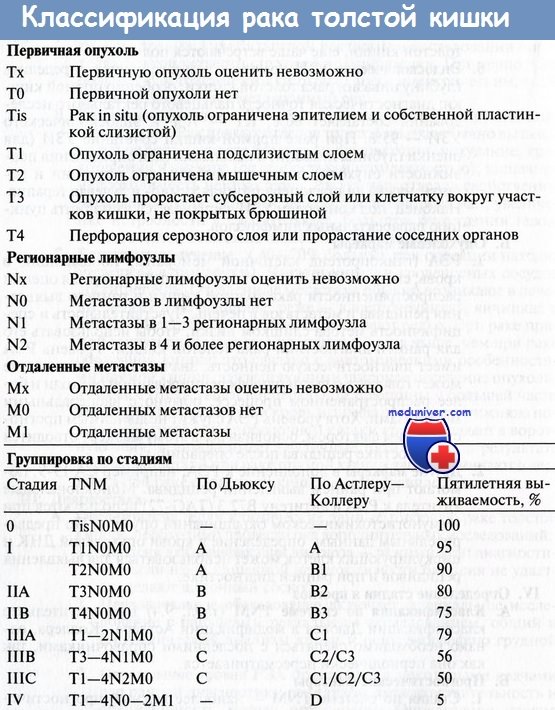
Прогноз заболевания и выживаемость больных напрямую связаны со стадией в моментустановления диагноза. Классификация колоректального рака по системе TNM, модифицированная классификация Dukes и выживаемость в зависимости от стадии болезни представлены ниже (табл. 9.13).
Классификация колоректального рака по системе TNM
Первичная опухоль (Т)
ТХ — недостаточно данных для оценки первичной опухоли.
Т0 — первичная опухоль не определяется.
Т1 — опухоль инфильтрирует подслизистую основу.
Т2 — опухоль инфильтрирует мышечную пластинку слизистой оболочки.
Т3 — опухоль проникает через мышечную пластинку слизистой оболочки в субсерозный слой или неперитонизированные участки околоободочной или периректальной клетчатки.
Т4 — опухоль распространяется на соседние органы и ткани и/или прорастает висцеральную брюшину.
Регионарные лимфоузлы (N)
NX — недостаточно данных для оценки регионарных лимфоузлов.
N1 — метастазы в 1-3 лимфоузлах.
N2 — метастазы в 4 лимфоузлах и более.
Отдаленные метастазы (М)
MX — недостаточно данных для оценки отдаленных метастазов.
М0 — отдаленных метастазов нет.
M1 — отдаленные метастазы есть.
Таблица 9.13. Классификация колоректального рака и 5-летняя выживаемость в зависимости от стадии

Примечание: Для установления индекса N0 требуется гистологическое исследование не менее 12 регионарных лимфоузлов.
Рак ободочной кишки
В 2006 г. в России выявлено 30 129 вновь заболевших. В 70 % случаев опухоль поражает сигмовидную и слепую кишку.
По гистологическому строению рак ободочной кишки в 80 % случаев представлен аденокарциномой разной степени дифференцировки, значительно реже встречаются другие формы рака (муцинозная аденокарцинома, железисто-плоскоклеточный рак, медуллярный рак, мелкоклеточный рак, перстневидноклеточный рак, плоскоклеточный рак (ПКР), недифференцированный рак).
Раково-эмбриональный антиген (раково-эмбриональный антиген (РЭА), гликопротеид с молекулярной массой 180 кДа) — наиболее известный маркер рака толстой кишки и выявляется примерно у 60% больных КРР. Высокий уровень РЭА до начала лечения служит фактором неблагоприятного прогноза, а сохраняющееся его повышение после операции может свидетельствовать о нерадикальности проведенного лечения. Наиболее часто определение уровня раково-эмбрионального антигена используется при оценке эффективности проводимой химиотерапии (XT), но только в дополнение к объективным методам обследования.
Основной метод лечения рака ободочной кишки — хирургический. Характер и объем вмешательства зависят от локализации и распространения опухоли, осложнений опухолевого процесса и общего состояния больного. 5-летняя выживаемость после радикальных операций составляет около 70%.
Заболевание протекает с большой частотой рецидивов, которые возникают примерно у 50% больных. При рецидивах рака ободочной кишки и IV стадии болезни проводят паллиативные резекции, накладывают обходные анастомозы и колостомы для ликвидации непроходимости и ее профилактики, что продлевает жизнь больных и улучшает ее качество. В последние годы все чаще проводится хирургическое удаление единичных метастазов в легких, яичниках, печени.
Метастазы рака ободочной кишки в печени требуют комплексного подхода, но хирургическое вмешательство считается наиболее адекватным методом лечения. Только активная хирургическая тактика может значительно продлить жизнь больных, 5-летняя выживаемость у таких пациентов составляет 20-40%, а стандарты адъювантной терапии после подобных операций в настоящее время разрабатываются.
При невозможности оперативного лечения проводят эмболизацию или химиоэмболизацию воротной вены или печеночной артерии, а также регионарную или системную XT. Внутриартериальная XT дает больший процент объективных ремиссий, но не улучшает показатели выживаемости по сравнению с системным лечением. При переводе процесса в операбельное состояние целесообразна резекция печени. Кроме того, используется криодеструкция метастазов под контролем интраоперационного УЗИ или радиочастотная абляция. Показатели выживаемости после применения этих методов выше, чем при одной системной XT.
Лучевая терапия при раке ободочной кишки малоэффективна, однако проводится с паллиативной целью, в частности, при поражении забрюшинных или периферических лимфоузлов. Xимиотерапия у больных с IV стадией или рецидивом заболевания используется с паллиативной целью. Рак ободочной кишки считается относительно резистентной к воздействию цитостатиков опухолью.
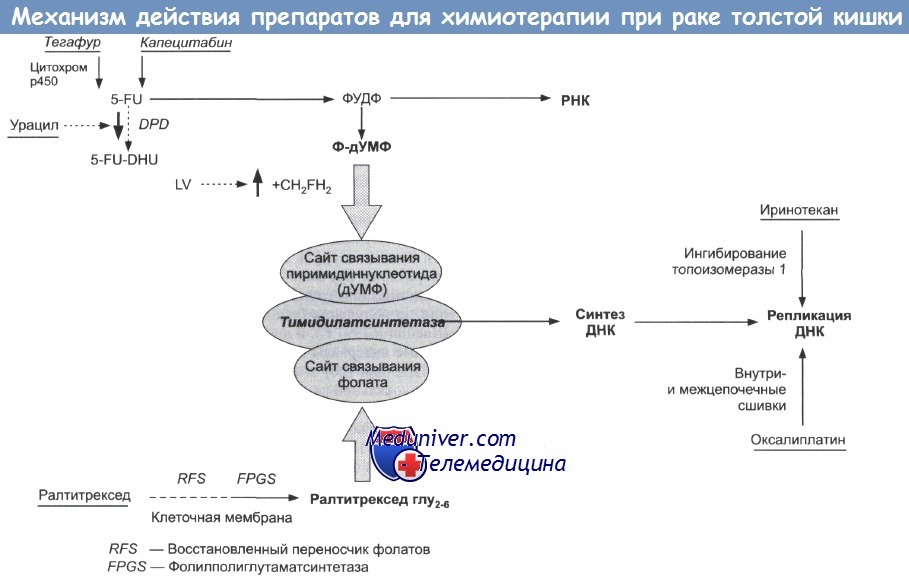
В течение более 40 лет единственным активным препаратом был антиметаболит из группы производных фторпиримидина — 5-фторурацил. Эффективность его не превышает 10-15%, причем чаще удается достичь лишь частичных ремиссий длительностью 4-6 мес. или стабилизации. Позже был создан препарат для перорального применения тегафур (Фторафур), который по сути является транспортной формой 5-фторурацила (5-ФУ). Биохимическая модуляция 5-ФУ и тегафура с помощью фолината кальция (Лейковорин) позволила увеличить их противоопухолевую активность до 20-30%.
В дальнейшем в клиническую практику вошли новые цитостатики из группы антиметаболитов — УФТ (смесь тегафура и урацила), который так же, как тегафур, создает постоянный уровень 5-ФУ в сыворотке крови, капецитабин (Кселода), который трансформируется в 5-ФУ непосредственно в опухоли, а также прямой ингибитор тимидилатсинтазы — ралтитрексед (Томудекс). Рак ободочной кишки оказался чувствителен к цитостатикам с оригинальным механизмом действия — ингибитору топоизомеразы I иринотекану (Кампто) и производному платины III поколения — оксалиплатину (Элоксатин).
Использование этих препаратов в составе лекарственных комбинаций (FOLF-ОХ, FOLFIRI) расширило возможности XT рака ободочной кишки, увеличив ее эффективность. Однако 5-ФУ не потерял своего значения, оставаясь основой лекарственной терапии рака ободочной кишки. В современных терапевтических режимах чаще всего используют длительные (22-46 ч) инфузий 5-ФУ в сочетании с лейковорином, вводимые еженедельно или 1 раз в 2 нед. Такие режимы имеют преимущества по непосредственной эффективности, переносимости и выживаемости больных.
В ряде случаев схемы комбинированной XT с использованием новых цитостатиков и фторурацила эффективны при резистентности к 5-ФУ с лейковерином. Актуален выбор последовательности различных режимов лечения. Комбинации FOLFOX и FOLFIRI равноэффективны в качестве первой линии. Монохимиотерапия капецитабином не менее эффективна, чем комбинация 5-ФУ с лейковорином, а комбинации на основе капецитабина служат альтернативой режимам с 5-ФУ. Вторая и третья линии XT зависят от первой.
Рак ободочной кишки — одна из немногих злокачественных опухолей, при которых внедрение современных молекулярно-нацеленных (таргетных) препаратов позволило существенно расширить возможности медикаментозного лечения и повысить его эффективность.
Антиангиогенный препарат бевацизумаб (Авастин) — МКА к VEGF — в сочетании с цитостатиками усиливает противоопухолевое действие последних, а в ряде случаев позволяет преодолеть резистентность к лекарственным средствам. Цетуксимаб (Эрбитукс) и панитумумаб (Вектибикс) — МКА к EGFR, гиперэкспрессия которого при метастатическом раке ободочной кишки отмечается более чем у 80% больных. Эти препараты подавляют способность опухоли к пролиферации, инвазивному росту и метастазированию.
Назначение цетуксимаба целесообразно при опухолях с немутантным (диким) типом гена KRAS, который является ключевым маркером, предсказывающим успех такого лечения. Эффективность комбинации FOLFOX или FOLFIRI с цетуксимабом в качестве первой линии достигает 80%. Комбинация цетуксимаба с иринотеканом (Кампто) позволяет преодолеть резистентность к последнему и контролировать рост опухоли в 50% случаев.
Таким образом, современная стратегия лечения метастатического КРР включает использование на разных этапах всех активных при этой опухоли препаратов в режиме практически непрерывного лечения, что позволяет увеличить медиану выживаемости пациентов более чем до 24 мес.
Адъювантная химиотерапия
В результате многочисленных рандомизированных исследований установлено, что применение комбинации фторурацил + фолинат кальция (Лейковорин) в течение 6 мес. после радикальных операций при III стадии рака ободочной кишки на 15-20 с увеличивает 5-летнюю выживаемость.
На сегодняшний день для адъювантного лечения вариантом выбора являются режимы FOLFOX-4 (12 курсов каждые 2 нед.), XELOX, а также капецитабин (Кселода) в монорежиме. Адъювантная XT при II стадии (стадия В2 по Dukes) рака ободочной кишки не считается стандартом, но применяется при наличии неблагоприятных факторов прогноза у молодых пациентов.
Режимы терапии
5-ФУ — 2600 мг/м2 24-часовая в/в инфузия еженедельно до проявления токсичности.
Тегафур (Фторафур) — 800-1000 мг/м2 внутрь ежедневно (доза делится на 2 приема) до суммарной дозы 30 г. Повторение цикла через 2-3 нед.
УФТ (тегафур/урацил) — 400 мг/м2 внутрь (доза делится на 2-3 приема) ежедневно в течение 3-4 нед. Повторение цикла через 1-2 нед.
Капецитабин (Кселода) — 2500 мг/м2 внутрь (доза делится на 2 приема) ежедневно в течение 2 нед. Повторение цикла через 1 нед.
Ралтитрексед (Томудекс) — 3 мг/м2 в/в 15-минутная инфузия 1 раз в 3 нед.
Иринотекан (Кампто) — 350 мг/м2 в/в 1-часовая инфузия 1 раз в 3 нед. или 125 мг/м2 в/в 90-минутная инфузия еженедельно в течение 4 нед. Повторение цикла через 2 нед.
Цетуксимаб (Эрбитукс) — 400 мг/м2 1-я доза, затем 250 мг/м2 в/в капельно еженедельно. Панитумумаб (Вектибикс) — 6 мг/кг в/в 90 мин 1 раз в 2 нед.
5-ФУ/ЛВ (режим Мейо)
Лейковорин — 20 мг/м2 в/в струйно в 1-5-й день.
5-ФУ — 425 мг/м2 в/в струйно после введения лейковорина в 1-5-й день. Повторение цикла через 3 нед.
5-ФУ/ЛВ (режим Rosvell Park)
Лейковорин — 500 мг/м2 в/в 2-часовая инфузия в 1,8, 15, 22, 29 и 36-й дни.
5-ФУ — 500 мг/м2 в/в струйно через 1 ч после начала инфузий лейковорина в 1,8, 15,
22, 29 и 36-й дни. Повторение цикла через 2 нед.
5ФУ/Л В (режим De Gramon)
День 1: лейковорин — 200 мг/м2 в/в 2-часовая инфузия, 5-ФУ — 400 мг/м2 в/в струйно, затем 5-ФУ — 600 мг/м2 в/в 22-часовая инфузия.
День 2: все повторяется. Повторение циклов каждые 2 нед.
Оксалиплатин — 85 мг/м2 в/в в 250-500 мл 5% раствора глюкозы 2-часовая инфузия в 1-й день.
Лейковорин — 200 мг/м2 в/в 2-часовая инфузия в 1-й и 2-й дни.
5-ФУ — 400 мг/м2 в/в струйно в 1-й и 2-й дни.
5-ФУ — 600 мг/м2 в/в 22-часовая инфузия в 1-й и 2-й дни. Повторение циклов каждые 2 нед.
Оксалиплатин — 100 мг/м2 в/в 2-часовая инфузия в 1-й день.
Лейковорин — 400 мг/м2 в/в 2-часовая инфузия в 1-й день.
5-ФУ — 400 мг/м2 в/в струйно в 1-й день.
5-ФУ — 2400 мг/м2 в/в 46-часовая инфузия в 1-й день. Повторение циклов каждые 2 нед.
Оксалиплатин — 50 мг/м2 в/в 2-часовая инфузия в 1,8, 15 и 22-й дни.
Лейковорин — 500 мг/м2 в/в 2-часовая инфузия в 1,8, 15 и 22-й дни.
5-ФУ — 2000 мг/м2 в/в 22-часовая инфузия в 1,8, 15 и 22-й дни. Повторение цикла через 2 нед.
Оксалиплатин — 85 мг/м2 в/в 2-часовая инфузия в 1, 15 и 29-й дни.
Лейковорин — 500 мг/м2 в/в струйно в 1, 8, 15, 22, 29 и 36-й дни. 5-ФУ — 500 мг/м2 в/в струйно в 1,8, 15, 22, 29 и 36-й дни. Повторение цикла каждые 8 нед.
Оксалиплатин — 135 мг/м2 в/в капельно в 1-й день.
Капецитабин — 2000 мг/м2/сут внутрь в 2 приема с 1-го дня (вечер) по 15-й день (утро).
Повторение цикла каждые 3 нед.
Оксалиплатин — 70 мг/м2 в/в капельно в 1-й и 8-й дни.
Капецитабин — 2000 мг/м2/сут внутрь в 2 приема с 1-го дня (вечер) по 15-й день (утро). Повторение цикла каждые 3 нед.
IFL (режим Saitz)
Иринотекан — 125 мг/м2 в/в 90-минутная инфузия в 1,8, 15 и 22-й дни.
Лейковорин — 20 мг/м2 в/в болюсно в 1,8, 15 и 22-й дни.
5-ФУ — 500 мг/м2 в/в болюсно в 1,8, 15 и 22-й дни. Повторение циклов каждые 6 нед.
Иринотекан — 180 мг/м2 в/в 90-минутная инфузия.
Лейковорин — 400 мг/м2 в/в 2-часовая инфузия.
5-ФУ — 400 мг/м2 в/в струйно.
5-ФУ — 2400 мг/м2 в/в 46-часовая инфузия. Повторение циклов каждые 2 нед.
Иринотекан — 180 мг/м2 в/в 90-минутная инфузия в 1-й день.
Лейковорин — 200 мг/м2 в/в 2-часовая инфузия в 1-й и 2-й дни.
5-ФУ — 400 мг/м2 в/в струйно в 1-й и 2-й дни.
5-ФУ — 600 мг/м2 в/в 22-часовая инфузия в 1-й и 2-й дни. Повторение циклов каждые 2 нед.
Иринотекан — 165 мг/м2 в 1-й день.
Оксалиплатин — 85 мг/м2 в 1-й день.
Лейковорин — 200 мг/м2 в/в 2-часовая инфузия в 1-й день.
5-ФУ — 3200 мг/м2 в/в 48-часовая инфузия. Повторение циклов каждые 2 нед.
Иринотекан — 80 мг/м2 в/в 2-часовая инфузия.
Лейковорин — 500 мг/м2 в/в 2-часовая инфузия.
5-ФУ — 2000 мг/м2 в/в 24-часовая инфузия еженедельно 4 нед. Повторение цикла через 2 нед.
Иринотекан — 250 мг/м2 в/в 90-минутная инфузия в 1-й день.
Капецитабин — 2000 мг/м2/сут внутрь в 2 приема с 1 -го дня (вечер) по 15-й день (утро). Повторение цикла каждые 3 нед.
Иринотекан — 180 мг/м2 в/в 90-минутная инфузия 1 раз в 2 нед.
Цетуксимаб — 400 мг/м2 1-я доза, затем 250 мг/м2 в/в капельно еженедельно.
Митомицин С — 5 мг/м2 в/в 1 раз в 3 нед. или 10 мг/м2 в/в 1 раз в 6 нед.
Капецитабин — 2000 мг/м2/сут внутрь в 2 приема в 1-14-й день 3-недельного цикла.
УФТ — 250 мг/м2/сут ежедневно внутрь в 1-14-й день.
Лейковорин — 90 мг/м2/сут ежедневно внутрь в 1-14-й день. Повторение цикла каждые 3 нед.
Добавление бевацизумаба к режимам FOLFOX, FOLFIRI, IFL, De Gramon, Rosvell Park: бевацизумаб 5 мг/кг в/в 30-90-минутная инфузия 1 раз в 2 нед.; к режимам XELOX, XELIRI — 7,5 мг/кг в/в 30-90-минутная инфузия 1 раз в 3 нед.
Добавление цетуксимаба к режимам FOLFOX, FUFOX, САРОХ, FOLFIRI, CAPIRI, UFT/LV: стартовая доза — 400 мг/м2 2-часовая инфузия, затем — 250 мг/м2 в/в 1-часовая инфузия еженедельно.
Адъювантная терапия рака ободочной кишки
Режим FOLFOX-4 — 12 циклов каждые 2 нед. в течение 6 мес. (только для III стадии). Режим XELOX — в течение 6 мес. (только для III стадии). Капецитабин в монорежиме — в течение 6 мес. Режим Мейо — 6 циклов. Режим Roswell Park — 4 цикла.
Рак прямой кишки
Рак прямой кишки составляет 20-25 % всех злокачественных опухолей желудочно-кишечного тракта (ЖКТ), а по темпам прироста заболеваемости вышел на 1-е место в большинстве развитых стран. В 2006 г. в России выявлено 16 466 вновь заболевших. По гистологическому строению рак прямой кишки чаще всего является аденокарциномой, включая муцинозную или перстневидноклеточную аденокарциномы, значительно реже встречается скиррозный рак, еще реже — нейроэндокринные опухоли. Заболеваемость мужчин и женщин приблизительно одинакова. Опухоль чаще развивается в ампулярном отделе прямой кишки, реже — в супраампулярном и редко — в аноректальном.
Прогноз заболевания напрямую зависит от стадии процесса в момент установления диагноза (см. табл. 9.13). Максимально точное предоперационное стадирование очень важно, т. к. помогает правильно планировать лечебную тактику. Обследование включает обязательное эндоскопическое исследование с биопсией, компьютерная томография (КТ) или магнитно-резонансная томография (МРТ) малого таза и брюшной полости, а также эндоскопическое ультразвуковое исследование (УЗИ). Последнее позволяет с точностью до 95% оценить степень прорастания опухолью стенки кишки и до 75% — состояние регионарных лимфоузлов.
Хирургический метод лечения — основной. 5-летняя выживаемость после радикальных операций 50-60%. При раке ректосигмоидного и верхнеампулярного отделов прямой кишки и локальном опухолевом процессе (опухоль до 5 см, нет данных о поражении лимфоузлов) методом выбора служит оперативное вмешательство; при большей распространенности заболевания, а также раке средне- и нижнеампулярного отделов прямой кишки показано комбинированное лечение с предоперационной лучевой терапией.
Лучевая терапия играет важную роль в лечении рака прямой кишки. Часто комбинируется с химиотерапией и служит важной частью адъювантного лечения. Доказано, что адъювантная химиотерапия 5-фторурацилом в сочетании с лучевой терапией (50-55 Гр) достоверно улучшает общую и безрецидивную выживаемость больных. Неоадъювантная химиолучевая терапия имеет преимущество в отношении локорегионарного контроля и частоты выполнения сфинктеросохраняющих операций по сравнению с адъювантным лечением, но не влияет на общую выживаемость.
Многочисленные международные исследования позволили выработать оптимальную современную стратегию комбинированного лечения рака прямой кишки, которая включает в себя неоадъювантную химиолучевую терапию (длительные инфузий 5-ФУ предпочтительны), оперативное вмешательство и последующую адъювантную химиотерапию.
Химиолучевая терапия часто используется в качестве самостоятельного метода лечения при неоперабельном раке прямой кишки. Рак прямой кишки является опухолью, чувствительной к воздействию цитостатиков. При распространенном процессе (IV стадия) используются те же препараты и лекарственные комбинации, что и при раке ободочной кишки.
Тактика лечения изолированного поражения печени также аналогична и включает хирургическое лечение или различные методы абляции. Все чаще выполняется резекция единичных метастазов в легких, иногда в сочетании с удалением метастазов в печени. Роль дополнительной системной химиотерапии после резекции печени не определена. В ряде случаев проводят регионарную внутриартериальную химиотерапию фторурацилом с фолинатом кальция, однако достоверного увеличения медианы выживаемости не выявлено.
Несмотря на отсутствие в настоящее время четко доказанных преимуществ эффективности новых лекарственных агентов или комбинаций перед 5-ФУ, они все чаще используются в нео- и/или адъювантной терапии рака прямой кишки.
Схемы лечения II-III стадии
Один из возможных вариантов лечения II-III стадии заболевания — проведение 4 курсов неоадъювантной XT по схеме XELOX, затем лучевая терапия на фоне капецитабина (Кселода) как радиосенсибилизатора (1650 мг/м2 в сутки ежедневно в течение всего курса лучевой терапии или 1800 мг/м2 в сутки с 1-го по 5-й день каждой недели), выполнение оперативного вмешательства, после которого назначается Кселода еще в течение 12 нед. в адъювантном режиме.
Варианты послеоперационного лечения при II-III стадии рака прямой кишки (если неоадъювантная химиолучевая терапия не проводилась):
1. 5-ФУ — 500 мг/м2 в/в струйно ежедневно в 1-5-й и 36-40-й дни, затем лучевая терапия 45 Гр (фракции по 1,8 Гр) в течение 5 нед. с дополнительным локальным облучением ложа опухоли в дозе 5,4-9,0 Гр начиная с 64-го дня на фоне длительной в/в инфузий 5-ФУ 225 мг/м2 в день одновременно с лучевой терапией в 64-105-й день, затем 5-ФУ — 500 мг/м2 в/в струйно ежедневно в 134-138-йи 169-173-й дни.
2. 5-ФУ — 500 мг/м2 3 дня в 1-ю и 5-ю недели с одновременной лучевой терапией в дозе 50-54 Гр.
3. Один цикл XT (Лейковорин 200 мг/м2 2-часовая инфузия, после которой 5-ФУ 450 мг/м2 в/в струйно 1 раз в неделю в течение 4 нед.), затем облучение всего малого таза в суммарной очаговой дозе (СОД) 45 Гр и дополнительно ложа опухоли в разовой очаговой дозе (РОД) 5 Гр на фоне 5-ФУ 500 мг/м2 в/в струйно в течение 3 первых и 3 последних дней лучевой терапии, затем продолжается XT комбинацией 5-ФУ/ЛВ суммарно до 6 курсов или до неприемлемой токсичности.
Хотя ведущим методом лечения при раке прямой кишки является хирургическая операция, химиотерапия применяется в рамках комбинированного лечения при местнораспространенных и метастатических формах заболевания. Она преследует следующие цели:
- Системное воздействие на опухоль с целью уничтожения/уменьшения метастазов, в том числе микрометастазов, которые могут пока никак не обнаруживаться.
- Приостановить рост опухоли на максимальный период.
- Перевести неоперабельные опухоли в резектабельное состояние для последующей попытки радикального удаления.
Долгое время для химиотерапевтического лечения рака прямой кишки применялся 5-фторурацил. Он и сегодня не утратил своей актуальности, но применяют его совместно с препаратами других групп:
- Препараты платины третьего поколения — оксалиплатин.
- Антагонисты пиримидинов — капецитабин.
- Капмтотецины — иринотекан.
Необходимый объем исследований
Перед началом лечения необходимо установить стадию заболевания и тип злокачественного новообразования, поскольку от этого будет зависеть тактика ведения пациента. Необходимо проведение комплексного обследования, включающего в себя следующие процедуры:
- Тотальная колоноскопия, а при ее невозможности ректо- и сигмоскопия. Позволяют визуализировать опухоль, оценить риск развития осложнений (перфорация, кровотечение) и взять материал для гистологии. Без данных этого анализа не рекомендуется начинать планирование лечения.
- МРТ органов малого таза позволяет определить глубину инвазии опухоли и состояние регионарных лимфатических узлов. Данное исследование необходимо для планирования хирургического и химиолучевого лечения.
- КТ органов брюшной и грудной полости — поиск отдаленных метастазов.
- УЗИ брюшной полости, проводится с аналогичной целью.
- Определение уровня онкомаркеров СА 19-9 и РЭА. Необходимо для оценки эффективности лечения, контроля рецидива и прогрессирования заболевания.
Также полученный опухолевый материал подвергается иммуногистохимическому и молекулярно-генетическому исследованию для решения вопроса о необходимости назначения дополнительных таргетных препаратов.
Противопоказания к химиотерапии
- Гиперчувствительность к химиопрепаратам.
- Уровень лейкоцитов ниже 5*10 9 для 5ФУ и ниже 2 для оксалиплатина, количество тромбоцитов меньше 10*10 10 .
- Печеночная и почечная недостаточность.
- Сепсис и другие тяжелые системные инфекции.
- Беременность. И кормление грудью.
- Наличие периферической сенсорной нейропатии до начала химиотерапевтического лечения с помощью оксалиплатина.
Показания к химиотерапии
Химиотерапия проводится, когда необходимо решить следующие задачи:
- Уменьшение объема опухоли на предоперационном этапе.
- Уничтожение оставшихся злокачественных клеток после оперативного лечения, в том числе микрометастазов.
- Приостановление роста злокачественного новообразования.
- Снижение риска рецидива и прогрессирования рака прямой кишки.
Лечение рака прямой кишки по стадиям
При первой стадии рака прямой кишки проводятся органосохраняющие щадящие операции. Химиотерапия не показана.
При 2 стадии проводят хирургическое лечение в объеме резекции или экстирпации прямой кишки совместно с удалением параректальной клетчатки и регионарных лимфатических узлов. Если при последующем гистологическом исследовании обнаруживаются опухолевые клетки в краях отсечения и удаленных лимфатических узлах, лечение дополняют химиолучевой терапией с фторпиримидинами. Адъювантная (предоперационная) химиотерапия не показана.
Лечение рака прямой кишки 3 стадии начинается с адъювантной химиолучевой или лучевой терапии и только через 6-8 недель после окончания первого этапа решается вопрос о хирургической операции. При локализованных опухолях проводят радикальные операции. При изначально неоперабельных опухолях делается попытка радикального лечения, или проводят паллиативные операции, паллиативную химиотерапию или продолжают лучевую терапию.
Лечение 4 стадии рака прямой кишки будет зависеть от количества, размеров и места локализации отдаленных метастазов. При единичных резектабельных метастазах возможно проведение радикальной операции. В остальных случаях назначается химиотерапия и после нескольких курсов оценивается состояние опухоли и делается попытка ее удаления. Если это невозможно, проводят поддерживающее и симптоматическое лечение.
Виды химиотерапии
Адъювантная химиотерапия при раке прямой кишки
Адъювантная или профилактическая химиотерапия применяется после радикальной операции при местнораспространенных опухолях, а также при наличии регионарных метастазов. Продолжительность такого лечения должна составлять не менее 6 месяцев.
Минимальным вариантом адъювантной химиотерапии при раке прямой кишки являются схемы, включающие в себя фторпиримидины. В основном применяется схема клиники Мейо, которая предполагает применение лейковарина с фторурацилом. Препараты вводятся в течение 5 дней, после чего делают перерыв. Следующий курс начинают на 29 день. Также используются другие схемы лечения с увеличенным содержанием лейковарина и 5-фторурацина (Roswell Park, AIO, модификации LV5FU или De Gramont).
Оптимальным вариантом адъювантной химиотерапии является назначение оксалиплатина с фторпинимидинами по режимам FOLFOX (оксалиплатин, лейковарин, 5-фторурацил) или XELOX (оксалиплатин и капецитабин). Если на фоне данного лечения развиваются симптомы нейротоксичности, препараты платины отменяют и лечение продолжают монотерапией фторпиримидинами.
На этапе адъювантной химиотерапии таргетное лечение моноклональными антителами не проводится.
Предоперационная (неоадъювантная) химиотерапия
Неоадъювантная химиотерапия рака прямой кишки показана при лечении метастатических и диссеминированных форм заболевания. Хирургическое удаление метастазов существенно улучшает прогноз больных и увеличивает пятилетнюю выживаемость до 30-40%, а при радикальном удалении этот показатель увеличивается до 60%.
К сожалению, радикальные операции на 4 стадии можно провести лишь 10-20% больных, в остальных случаях процесс неоперабельный. Чтобы помочь таким пациентам, назначают неоадъювантную химиотерапию. Ее целью является повышение резектабельности опухоли и/или продление жизни больному. В рамках неоадъювантной химиотерапии используются комбинации FOLFOX, XELOX, FOLFIRI.
Химиотерапия колоректального рака с отдаленными метастазами
При изначально резектабельных опухолях используются следующие тактики:
- Хирургическое удаление метастазов с последующей химиотерапией по режиму FOLFOX или XELOX.
- Периоперационная химиотерапия. Сначала идет три месяца химиотерапии, затем удаление метастазов, а потом еще 3 месяца химии.
Если метастазы нерезектабельны, или потенциально резектабельны, проводится химиотерапия по режимам FOLFOX, XELOX, FOLFIRI (иринотекан, лейковарин, 5-ФУ) до перевода метастазов в резектабельное состояние. Если не выявлены мутации в гене RAS, к первым двум схемам возможно добавление таргетных анти-EGFR препаратов.
Также для улучшения качества лечения могут применяться следующие варианты:
- Добавление к двухкомпонентных химиотерапевтическим схемам бевацизумаба (без учета мутации RAS).
- Применение тройной комбинации FOLFOXIRI, в ряде случаев ее усиливают моноклональными антителами. Однако такой режим довольно токсичен и требует тщательного контроля.
Химиолучевая терапия рака прямой кишки
Интенсивные курсы химиолучевой терапии (ХЛТ) могут стать альтернативой хирургической операции у пациентов с локализованной и местнораспространенной опухолью прямой кишки. Пока такое лечение не утверждено в протоколах, но ведутся клинические испытания (IWWD) направленные на изучение данного вопроса и расширение показаний для безоперационной терапии.
В настоящее время ХЛТ применяться в рамках комбинированного лечения, на дооперационном или послеоперационном этапе. Проводится дистанционная лучевая терапия в разовой дозе 2 Гр до суммарной очаговой дозы на зону регионарных метастазов 44 Гр, на опухоль 50-60 Гр, в зависимости от локализации и степени распространения опухоли. Облучение проводится курсами по 5 дней с перерывом в 2 дня. Параллельно с этим проводится химиотерапия фторпиримидинами (монотерапия), или совместно с оксалиплатином.
Таргетная терапия при раке прямой кишки
Таргетная терапия — это лечение, основанное на воздействии на молекулярные мишени, которые играют ключевую роль в патогенезе злокачественного новообразования. Таких мишеней известно очень много. В рамках лечения рака прямой кишки наибольший интерес представляют ингибиторы эпидермального фактора роста EGFR и сосудистого фактора роста.
Рецепторы EGFR располагаются на клеточных мембранах и при контакте с эпидермальным фактором роста запускают каскад химических реакций, которые регулируют процессы клеточного роста и размножения. Если блокировать этот рецептор с помощью антител, передача сигнала станет невозможной, и процесс пролиферации остановится.
Такими блокаторами при лечении рака прямой кишки выступают два препарата: цетуксимаб и панитумумаб. Их назначение улучшает ответ опухоли на химиотерапию и увеличивает время до прогрессирования рака.
Однако такое лечение показано не всем. Например, при мутации в гене KRAS, в большом количестве начинают синтезироваться сигнальные молекулы, которые занимают промежуточное положение при передаче сигнала от рецептора EGFR до ядра, поэтом его блокирование не приведет к улучшению ситуации. Поэтому при наличии данной мутации, лечение антителами к EGFR не показано.
Второй мишенью является сосудистый фактор роста. Опухоль стимулирует рост кровеносных сосудов за счет выделения большого количества эндотелиального фактора роста. Бевацизумаб блокирует его и нарушает рост новых кровеносных сосудов, тем самым лишает опухоль полноценного питания и способности к гематогенному метастазированию.
Осложнения и методы их предотвращения
- Тошнота и рвота. Для предотвращения и купирования этих проявления назначаются различные антиэметики, например, дексаметазон, блокаторы серотонина и др.
- Диарея. Для восполнения жидкости назначается регидратационная терапия, для купирования диареи применяются препараты, действующие на моторную функцию кишечника (лоперамид, аттапульгит), для уменьшения болевого синдрома используются спазмолитики и анальгетики.
- Мукозит — специфическое воспаление полости рта. Для его устранения используются дезинфицирующие растворы местного действия, обволакивающие и ранозаживляющие средства, а также анальгетики.
- Миелотоксичность. При существенном угнетении кроветворения необходима коррекция доз цитостатиков.
- Дерматотоксичность, которая проявляется в виде очагов сыпи, гиперпигментации или зуда. Также может быть ладонно-подошвенный синдром, с покраснением, отеком и зудом кожи рук и стопы. При развитии такого осложнения требуется снижение дозы химиотерапевтических препаратов или их отмена.
Критериями эффективности химиотерапии является уменьшение размеров опухоли по данным объективного обследования: КТ, МРТ, УЗИ.
Вероятность рецидива после радикальных резекций, выполненных по поводу рака в стадии II и III без признаков резидуальной опухоли (R0 резекция), составляет 40-50% случаев.
Углубление знаний о патофизиологии опухоли, доступность различных химиопрепаратов, более совершенные схемы адъювантной и неоадъювантной химиотерапии привели к признанию ее роли, продемонстрировав преимущество комбинированного подхода над хирургическим лечением в отношении ответа опухоли и выживаемости в больших группах больных раком.
Выбор конкретного препарата, схемы, пути введения, времени и продолжительности зависит от нескольких факторов: гистопатологических особенностей, стадии, первичных и вторичных очагов опухоли, общего состояния больного, ответа на лечение, побочных эффектов и выполненной или планируемой операции.
Доказательства преимуществ постоянно изменяются и обновляются по мере получения данных новых исследований.
Показания для химиотерапии:
• Рак толстой кишки, стадия III (TxN1-2).
• Рак толстой кишки, стадия IIВ (T4N0), в частности при перфорации.
• Рак толстой кишки, стадия IIА (ТЗ) с неблагоприятными особенностями: пери-туморальной лимфоваскулярной инвазией, неадекватным количеством исследованных лимфоузлов, низкой дифференцировкой.
• Рак прямой кишки, стадия II (u/T3-4N0) и III (u/pTxN1-2).
• Рак прямой кишки, стадия Т2 после трансанального местного иссечения.
Сумма доказательств эффективности химиотерапии рака толстой кишки
1. Стадия III колоректального рака:
• Послеоперационная химиотерапия в течение 6 месяцев является достаточной (у более длительного курса преимуществ нет).
• Непрерывное введение 5-FU/LV лучше, чем болюсное.
• Необходимость в левамизоле отсутствует.
• Комбинация 5-FU/LV и оксалиплатина лучше, чем 5-FU/LV.
• Капецитабин также эффективен и даже несколько лучше, чем 5-FU/LV.
• Эффективность адъювантной химиотерапии не зависит от возраста больного.
• Роль в адъювантном режиме таких препаратов, как иринотекан, цетуксимаб или бевацизумаб не документирована, но они являются предметом текущих исследований.
2. Стадия II колоректального рака:
• Не документированы преимущества в выживаемости при адъювантной терапии у больных со II стадией заболевания при стандартном риске.
• Химиотерапия при II стадии заболевания высокого риска выглядит логически оправданной, но спорной из-за отсутствия объективной проверки достоверности => необходимость в дальнейших исследованиях.
Альтернативы химиотерапии рака толстой кишки:
• Только операция: рак толстой кишки — стадия I (pT1-2N0), стадия IIА (pT3N0); у сохранных больных со II стадией рака толстой кишки при отсутствии неблагоприятных прогностических факторов рутинное применение адъювантной химиотерапии не рекомендуется.
• Радиотерапия или радиотерапия + операция: все реже применяемые методы при опухолях ЖКТ/аноректальной области.
Схемы адъювантной химиотерапии рака толстой кишки (колоректального рака)
1. Еженедельный болюс 5-FU+ лейковорин (Розвел Парк):
Болюсное введение 5-FU + лейковорин еженедельно в течение 6 недель, 2 недели перерыв => 3 цикла каждые 8 недель.
Показания. Стандартная схема, если имеются противопоказания или непереносимость оксали-платина.
Противопоказания. Текущий сепсис, нейтропения, печеночная недостаточность, почечная недостаточность.
Токсичность и побочные эффекты. Степень III и IV: диарея (40%), стоматит (1%), нейтропения (4%).
2. Ежемесячный болюс 5-FU+ лейковорин (Мэйо):
Болюсное введение 5-FU+ лейковорин с 1 по 5 день с последующим 3-х недельным перерывом => 6 циклов каждые 4 недели.
Показания. Стандартная схема при противопоказаниях или непереносимости оксалиплатина.
Противопоказания. Текущий сепсис, нейтропения, печеночная/почечная недостаточность.
Токсичность и побочные эффекты. Более токсичная, по сравнению с другими 5-FU/LV схемами => степень III и IV: диарея (13-21%), стоматит (14-18%), нейтропения (16-55%).
3. Капецитабии (Кселода):
Капецитабин: перорально два раза в день ежедневно в течение 14 дней + перерыв 7 дней => всего 8 циклов каждые 3 недели.
Показания. Альтернативная/новая схема, если имеются противопоказания или непереносимость оксалиплатина.
Противопоказания. Текущий сепсис, нейтропения, печеночная/почечная недостаточность.
Токсичность и побочные эффекты. Переносимость лучше, чем при внутривенном введении 5-FU/LV.
4. ФОЛиниевая кислота + Фторурацил + ОКСалиплатин (FOLFOX4):
Оксалиплатин в/в в первый день; лейковорин в/в в первый и второй дни; 5-FU в/в болюсно с последующей непрерывной инфузией в течение первого и второго дня => всего 12 циклов каждые 14 дней.
Показания. При переносимости — стандартная интенсивная схема выбора, в частности при агрессивных опухолях и у молодых больных; риск редукции дозы 18-25% по сравнению с болюсным введением 5-FU/LV (безрецидивная выживаемость — 78% и 73% соответственно).
Противопоказания. Аллергические реакции. Предшествующая нейропатия.
Токсичность и побочные эффекты. Нейтропения (>40%), фебрильная нейтропения, периферическая нейропатия (острая 3 степени — 12%, отдаленная персистирующая — 1%).
5. ФОЛиниевая кислота + Фторурацил + ОКСалиплатин (FOLFOX 6):
Оксалиплатин в/в в первый день; лейковорин в/в только в первый день; 5-FU в/в болюсно с последующей непрерывной инфузией (более высокая доза, чем при FOLFOX4) в течение первого и второго дня => всего 12 циклов каждые 14 дней.
Показания. Те же, что и при FOLFOX4, но доза оксалиплатнна выше, а назначение более удобно для больного: необходимость госпитализации только в первый день каждого цикла.
Противопоказания. Аллергические реакции. Предшествующая нейропатия.
Токсичность и побочные эффекты. Нейтропения (>40%), фебрильная нейтропения, периферическая нейропатия (острая III степени — 12%, отдаленная персистирующая — 1%).
6. КАПЕцитабин (КСЕЛода) + ОКСалиплатин (САРЕОХ, XELOX):
Оксалиплатин в/в в первый день; капецитабин нерорально два раза в день ежедневно с 1 по 14 дни + 7 дней перерыв => каждый 21 день 2 раза в день.
Показания. Альтернативная схема FOLFOX с удобным режимом приема.
Противопоказания. Текущий сепсис, нейтропения, печеночная/почечная недостаточность.
Токсичность и побочные эффекты. Сравнимый с FOLFOX или несколько лучший профиль токсичности.
