
«В человеке все должно быть прекрасно. » — сказал классик. Ну, а вдруг в этом самом человеке есть «не все». То есть не хватает чего-то очень важного, например, какого-нибудь органа? Чем это грозит? Насколько ужасными будут последствия?
Начнем с того, что органы могут быть удалены по трем причинам:
- потому что считаются «лишними» или «опасными»;
- по медицинским показаниям — вследствие болезни;
- и, наконец, человек может расстаться с органом добровольно — стать донором.
«Лишние органы»
В конце XIX – начале XX века, после того, как Ницше провозгласил свое «Бог умер», человек из твари дрожащей решил переквалифицироваться в творца. Умами овладели мечты о создании «нового человека». Произведения, типа «Собачьего сердца» Булгакова и «Острова доктора Моро» Уэллса были не единичными: в 1920-е годы вышла повесть об усовершенствованном коммунистическом человеке будущего, у которого все внутренние органы рационализированы, а лишние удалены за ненадобностью. Но поскольку новых людей создавать пока не получалось, решили совершенствовать обычных, вырезая у них «ненужные» и «опасные» органы. К ним были отнесены аппендикс, миндалины и крайняя плоть. Одно время считалось опасным иметь толстую кишку, но удалять ее побоялись.
Профилактическое удаление лишних органов достигло расцвета в Америке во второй половине XX века, но постепенно сошло на нет.
В настоящее время признано, что органы лишними не бывают, так, например, аппендикс является «депо» кишечных бактерий, а миндалины несут функцию иммунной защиты и без них возрастает риск заболеть бронхитом или пневмонией. В настоящее время аппенэктомия и тонзилэктомия проводятся только по медицинским показаниям.
По медицинским показаниям
1. Холецистэктомия (удаление желчного пузыря)
Пожалуй, чаще всего по медицинским показаниям удаляют желчный пузырь. В основном, по причине появления в нем камней. Счет этих операций в год идет на сотни тысяч. Операция относительно безопасна. В наши дни ее, как правило, стараются проводить лапароскопическим доступом, не оставляющим заметного шрама и меньше повреждающим мышцы и соединительные ткани живота.
К недостаткам операции помимо возможных осложнений в послеоперационном периоде (например, забытый тампон или поврежденный желчный проток), относится поступление желчи в кишку, когда ей заблагорассудится, что приводит к нарушению пищеварения и возникновению неприятных симптомов.
В настоящее время камни желчного пузыря во многих случаях сначала пробуют растворить с помощью лекарственных средств.
2. Спленэктомия (удаление селезенки)
Селезенка чаще всего удаляется при болезнях крови или травмах. Хотя этот орган выполняет иммунную функцию и участвует в кроветворении, его отсутствие пациенты переносят хорошо. Наиболее серьезным последствием спленэктомии становится повышенная восприимчивость к бактериальным инфекциям в первые годы после операции.
Раньше селезенка считалась органом, отвечающим за чувство юмора, однако проведенное британскими учеными исследование не показало различий в чувстве юмора у людей с селезенкой и без нее.
3. Резекция (удаление) желудка
Резекции желудка долгое время выполнялись в очень больших количествах для лечения язвенной болезни (в полном соответствии с главным хирургическим принципом «нет органа — нет проблемы»), пока не появились эффективные блокаторы секреции, и не началась борьба с Хеликобактером Пилори.
В настоящее время показания к резекции желудка ограничены. Как бы мы ни жаловались на дороговизну и неэффективность нынешних лекарственных препаратов, многим они позволили сохранить желудок. Хотя человек вполне может прожить без него — пища будет перевариваться и всасываться в кишечнике. Минусы жизни без желудка: после операции часто развивается анемия, и появляются камни в желчном пузыре.
4. Удаление поджелудочной железы
А вот резекция малоизвестного органа — поджелудочной железы, напротив, ведет к значительному нарушению пищеварения. После операции пациенту приходится постоянно принимать ферментные препараты. Кроме того, в поджелудочной железе вырабатывается инсулин, и ее удаление приводит к развитию сахарного диабета.
5. Удаление щитовидной железы
Иногда необходимой операцией (например, при тиреотоксикозе) является резекция щитовидной железы. Однако из-за частых и серьезных осложнений, щитовидку удаляют только в том случае, когда все остальные методы лечения не помогают.
После операции пациенту назначается пожизненная заместительная терапия гормонами.
6. Удаление кишечника
Кишечник человека в среднем от четырех до шести метров длиной, и ученые давно задавали вопрос — зачем столько? Не лучше ли, чтобы он был короче и удобней?
К счастью, с профилактической целью (например, при лечении дисбактериоза) кишечник никто никогда не удалял, но резекции части кишечника проводят при возникновении, например, кишечной непроходимости, при опухолях. Как правило, больной хорошо переносит удаление примерно 40 % тонкой кишки, и кишечник приспосабливается к новым условиям. Резекция большего объема ведет к тяжелым расстройствам пищеварения, развитию анемии, постоянным поносам.
Резекция части толстой кишки (гемиколэктомия) также проводится по серьезным показаниям (рак, болезнь Крона). Ее последствия – образование камней в желчном пузыре, нарушение пищеварения вследствие уничтожения толстокишечной флоры. Кроме того, возможны осложнения, связанные с самой операцией.
Донорство
Про забор донорских органов у трупов знают все. Альтернативой ему является забор органов у живых людей. Такие органы лучше приживаются. Да и то, что такие операции проводятся не в срочном, а в плановом порядке, тоже улучшает их прогноз.
В нашей стране разрешен забор органов только у кровных родственников больного, в то время как в США донорами могут стать супруг, друзья, да и просто незнакомые люди. Вопреки распространенному мнению, альтруизм — необходимое условие трансплантации от живых доноров, чтобы избежать торговли органами. И хотя доноры не получают денег и часто даже не знают, кому пересадят их орган, число таких добровольных жертвователей растет.
Основные донорские органы – почка, печень, костный мозг. Смертность при донорских операциях практически отсутствует.
Как и в случае с любым парным органом (например, с легкими) при потере одного органа, другой орган гипертрофируется и работает за двоих. При заборе одной почки оставшейся хватает для функционирования, и единственный риск — риск заболевания последней почки.
При заборе печени для пересадки выбирают правую долю печени (около 60% органа) при этом оставшаяся доля печени регенерирует, и орган достигает дооперационных размеров. Однако у 14 % доноров печени могут возникнуть послеоперационные осложнения.
Наиболее безопасным видом донорства является донорство костного мозга. Фактически, эта процедура немногим сложнее обычного забора крови. Донора госпитализируют всего на один день, из костей скелета специальными иглами высасывают не более 5 % костного мозга. Его потеря при этом не ощущается, и его объём полностью восстанавливается в течение двух недель.
Алексей Подольский
Мне 48 лет. ПВ 2016 году у меня был диагностирован семейный полипоз толстого кишечника. В феврале 2017 года была сделана операция "колэктомия с низкой передней резекцией прямой кишки и наложением илеоанального анастомоза". В июне произведена операция по ликвидации двуствольной илеостомы внутрибрюшным способом.
С этого момента начались проблемы. Помимо частого и жидкого стула происходит сильное раздражение (до кровотечения) "остатков" прямой кишки. Раздражение сопровождается невыносимыми болями. Пытался спасаться от этих проблем путем диеты — не помогает.
Скажите, пожалуйста, существуют ли какие-либо средства, которые могут облегчить мои страдания?
![]()
Без толстого кишечника люди жить не могут. В толстом кишечнике происходит всасывание полезных переработанных веществ, это его основная функция. В Вашем случае удалена только часть толстого кишечника.Конечно, это приведет к нарушениям процессов всасывания.Видимо , есть еще проблемы колита, воспаления слизистой толстого кишечника и проблемы с перевариванием пищи в верхних отделах кишечника, которые связаны с недостаточностью ферментов пищеварения.В таких случаях наладить процесс пищеварения с помощью диеты не получиться.Необходим о комплексное лечение и подбор ферментов.Для этого необходимо самому пациенту условно вести дневник, где отмечать на какие продукты реакция кишечника сильнее.В зависимости от этого осуществляется подбор ферментов и соответственно продуктов. Процесс не простой, но ничего невозможного нет. Лучше Вас никто не сможет услышать ваш организм.Здоровья Вам, оптимизма, терпения и все получится.
![]()
Илеоанальный анастомоз, человек сам не придумает. В данной ситуации выполнена тотальная колэктомия, а не гемиколэктомия(полов ина толстого кишечника). Может быть правосторонней и левосторонней. Жизнь с такой дефекацией действительно будет, как у утки. Это бы, ещё ничего, если бы не явление проктита в остатке анального канала. Среда в тонком кишечнике щелочная, а в остатке прямой кишки кислая. Сфинктеров нет и в результате будет постоянный анастомозит, места соединения тонкой кишки с прямой. Как хочешь назови это место. Возможно, задерживать жидкий стул поможет лоперамид. А, в анус необходимы масляные микроклизмы из спринцовки: масло облепихи, шиповника. Сколько раз делать следует самому сориентироваться, что бы масло дольше удерживалось в анальном канале. Жидкий кал его будет смывать. Есть ректальные свечи с облепихой. Смысл микроклизм и свеч в защите слизистой анального канала и снятия воспаления. Диеты, вряд ли дадут толк. Ещё, стоит попытаться вводит в анус метилурациловую мазь, заживляет слизистые. В таких микроклизмах искать своё, подходящее.
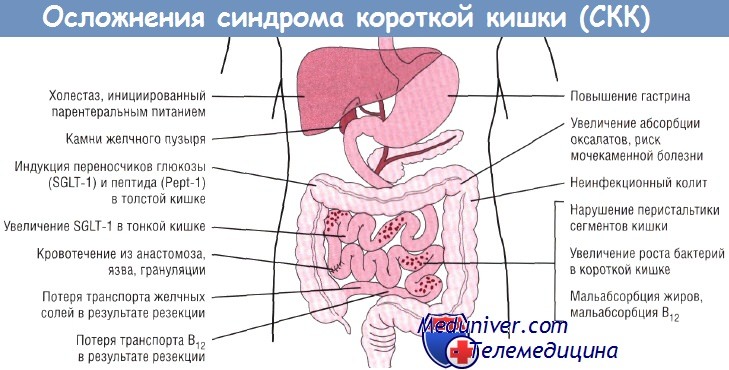
Наиболее важным фактором, определяющим тяжесть мальабсорбции при синдроме короткой кишки (СКК), является длина резецированной кишки. В нормальных условиях тонкая кишка получает 185 мл/кг секрета из слюны, желудка и панкреатобилиарной системы в дополнение к 100 мл/кг молока и других жидкостей. Из этих 285 мл/кг в тонкой кишке всасывается 225 мл/кг (результаты получены при исследовании пациентов, имеющих илеостому).
Кроме того, в тонкую кишку поступает около 90% общего количества калорий, остальные 10% формируются путем ферментации неабсорбированных углеводов в толстой кишке в ходе обмена веществ КЦЖК. Таким образом, в тонкой кишке при нормальных условиях должно поглощаться более 80% солей и воды. Если тонкая кишка после резекции не адаптируется, потеря даже 50% жидкости может привести к дегидратации и смерти.
Помимо длины тонкой кишки есть и другие важные факторы, влияющие на абсорбционную функцию кишки: сохранение илеоцекаль-ного сфинктера (клапана), функциональные возможности оставшихся тонкой кишки и толстой кишки, способность оставшегося после резекции кишечника к адаптации.
Илеоцекальный сфинктер является механическим препятствием для миграции бактерий в просвет тонкой кишки и помогает регулировать поступление жидкости и питательных веществ в толстую кишку. Потеря этого барьера — предрасполагающий фактор развития сепсиса, вызванного собственной кишечной микрофлорой, но, вероятно, не влияет на конечную цель — достижение полного усвоения энтерального питания. При отсутствии илеоцекального сфинктера увеличивается размножение бактерий в просвете тонкой кишки, что во многих случаях ведет к диарее, нарушению всасывания жиров и витамина В12 через деконъюгацию желчных солей, дефициту жидкости, кишечным коликам, метеоризму, нарушению функции печени и воспалению кишки.
У многих детей с синдромом короткой кишки (СКК) происходит активация неспецифических факторов иммунной системы. В одном исследовании было показано, что у пациентов с синдромом короткой кишки (СКК), находящихся на длительном парентеральном питании в домашних условиях, повышается концентрация растворимого рецептора II к TNF и IL-6 в суточной моче и сыворотке крови по сравнению с контрольной группой соответствующего возраста, что указывает на наличие персистирующей воспалительной реакции слабой активности у детей, получающих ППП в домашних условиях.
Исследования Wilmore и соавт. показали, что существует критическая длина тонкой кишки (от связки Трейца до терминального отдела подвздошной кишки), при уменьшении которой жизнь большинства младенцев будет зависеть от парентерального питания. В этих работах отмечено, что критическая длина тонкой кишки равна 40 см. Стратегия хирургического вмешательства должна быть направлена на сохранение как можно больших участков кишки. Для этого некоторые хирурги создают высокую энтеростому с формированием множественных анастомозов «конец в конец», другие используют технику "clip and drop back".
Учитывая, что 40 см составляют 1/6 (17%) нормальной длины тонкой кишки доношенных детей, исследователи протестировали в эксперименте критический процент оставшейся тонкой кишки у лабораторных крыс. Опыты на животных показали, что для поддержания жизненных функций путем энтерального питания необходимо 20% общей длины тонкой кишки. Тем не менее выживаемость пациентов значительно улучшилась с приобретением опыта по выхаживанию таких больных и назначению парентерального питания. Большое проспективное исследование Goulet и соавт. в Париже (Франция) показало, что около 65% детей с длиной кишки от 40 до 80 см в конечном счете перестают зависеть от парентерального питания. Более 90% детей, у которых длина кишечника превышала 80 см, не нуждались в парентеральном питании.
Однако были обнаружены значительные индивидуальные различия, о чем свидетельствует опыт Калифорнийского университета в Лос-Анджелесе (University of California, Los Angeles): несколько детей с оставшимися 20-30 см тощей кишки и подвздошной кишки обходились без парентерального питания. В Университете Северной Каролины (University of North Carolina) был обследован ребенок с кишечником длиной 26 см, переставший зависеть от парентерального питания в возрасте 9 мес. Что примечательно, есть сообщение о двух младенцах, у которых после резекции оставалось 12 см тонкой кишки и которые в парентеральном питании не нуждались. В недавней серии публикаций из Саудовской Аравии описан поразительный результат лечения восьми пациентов с экстремальной формой синдрома короткой кишки (СКК), большинство из которых имели заворот средней кишки с неповрежденным илеоцекальным клапаном.
Из них четверо имели длину тонкой кишки от 0 до 10 см, один — 10-25 см и трое — 25-75 см. Был использован протокол кормления через рот в сочетании с парентеральным питанием (т.е. без гастростомии или кормления через назогастральный зонд), в процессе лечения шесть пациентов перестали получать парентеральное питание. Оставшиеся два пациента получали парентеральное питание не каждый месяц (оба имели менее 10 см тонкой кишки). При рентгенологическом контроле длина тощей кишки и подвздошной кишки увеличилась примерно на 450% в течение первых 2,5 года после резекции.
Чаще всего зависимые от парентерального питания дети становились независимыми от него к 2-3-летнему возрасту, однако в группе детей с длиной кишки менее 40 см были нередки случаи регресса энтерального питания и возвращения к парентеральному.
Прогноз по длине кишечника менее надежен в группе глубоко недоношенных детей, поскольку они не имеют 260-275 см тонкой кишки до достижения ими постконцептуального возраста, соответствующего доношенной беременности. Полезными для определения прогностических факторов стали несколько крупных исследований длины кишечника у мертворожденных или умерших недоношенными младенцев. Результаты исследований показали среднюю длину кишечника в 25 нед гестации 125 см и в 30 нед гестации» 180 см. Если принять за эталон, что для выживания необходимо 20% тонкой кишки, то младенец в возрасте 25 нед гестации может быть толерантен к энтеральному питанию без осложнений, имея всего 25 см тонкой кишки.
Хотя исследования длины кишечника выявили относительно надежные прогностические факторы, определяющие независимость ребенка от парентерального питания, продолжительность формирования толерантности к энтеральному питанию предсказать невозможно. 12-летний опыт Sondhemier и соавт. показал, что все дети, которые перестали зависеть от парентерального питания, стали таковыми к 36 мес жизни, 16-летний опыт Rhoads и соавт. в Университете Северной Каролины оказался идентичным. Наиболее важным прогностическим фактором, установленным в Денверском исследовании, стал процент толерантности к энтеральному питанию в возрасте 12 нед.
В этот очевидно критический момент рассчитывали процент суточной энергии, поступающей энтеральным путем, который составил 42% в группе детей, ставших независимыми от парентерального питания, и 10% — в группе детей, которые всегда зависели от парентерального питания (р = 0,0008). Однако возможны единичные случаи прекращения парентерального питания, но не в период полового созревания.
Точно установлено, что у взрослых полная адаптация происходит при наличии более 60 см тонкой кишки при сохраненной толстой кишке.
